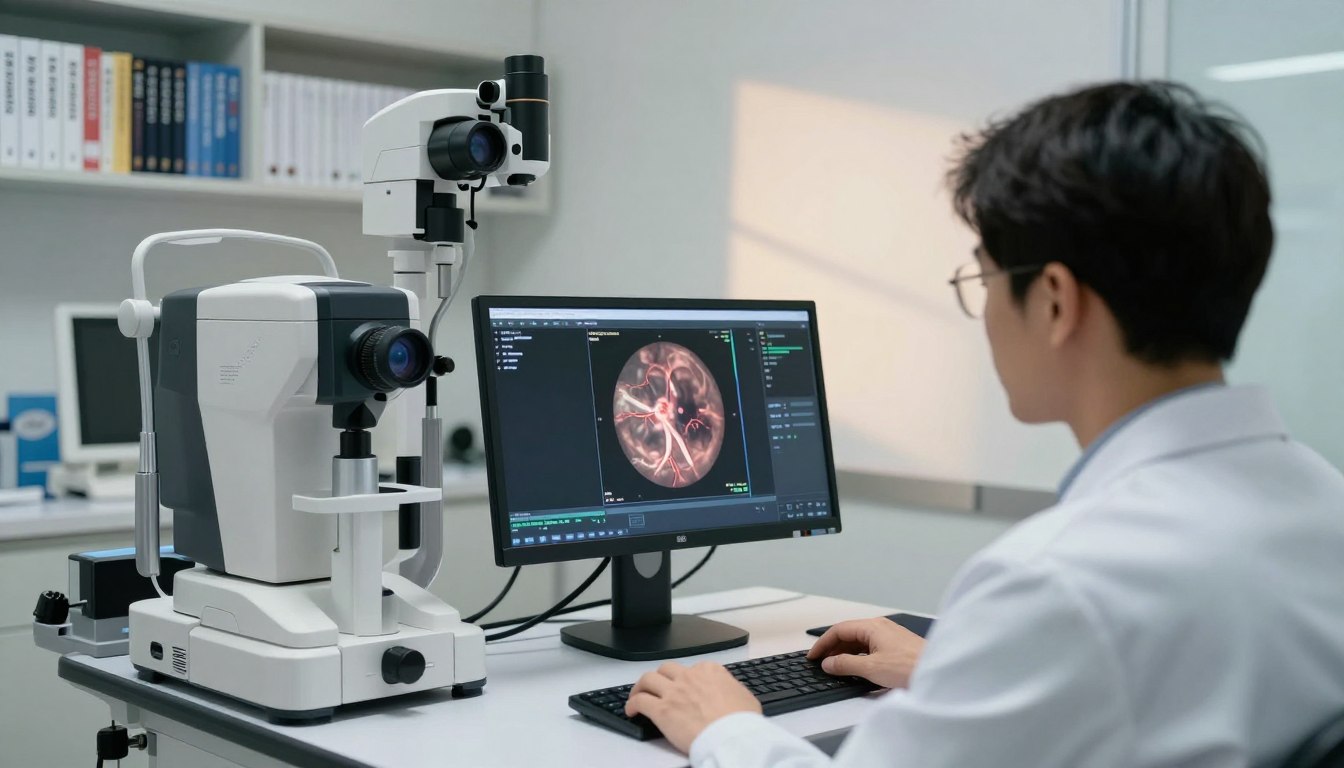
IDx-DR ist ein als Medizinprodukt zugelassenes, autonomes Diagnosesystem zur Erkennung diabetischer Retinopathie. Es besitzt eine FDA-Zulassung und eine CE-Kennzeichnung (Klasse IIa) für cloud-basierte Auswertung von Fundusbildern.
Der Praxisnutzen richtet sich an Entscheider:innen in Deutschland: diabetologische Zentren, Hausarztpraxen, MVZ und Kliniken.
„Ohne Arzt“ bedeutet hier: geschultes Personal macht die Bildaufnahme, das System wertet autonom aus und liefert eine klare Handlungsanweisung.
Wesentliche Punkte sind Workflow (zwei Bilder pro Auge, Auswertung in
Transparente Erwartungssteuerung: Die Performance hängt stark von Bildqualität ab. Fehlende oder nicht auswertbare Aufnahmen sind im Alltag reale Kostenfaktoren.
Diese Review basiert auch auf Real-World-Daten aus Deutschland (875 Patient:innen) und interpretiert Sensitivität, Spezifität, Übereinstimmungsraten und Under-/Overgrading.
Wesentliche Erkenntnisse
- Schneller Zugang zu Screening in ressourcenarmen Bereichen.
- Klares Output-Design erleichtert Entscheidungsprozesse vor Ort.
- Leistung ist bildqualitätsabhängig; Ausfallquoten planen.
- Integration in Praxis-Workflows möglich und praxisrelevant.
- Evidenz aus 875 Patient:innen liefert belastbare Kennzahlen.
- Fokus auf Erkennung schwerer, vision-bedrohender Befunde.
Warum autonome KI-Screenings für Diabetische Retinopathie jetzt relevant sind
Die wachsende Zahl an Menschen mit Typ‑2‑Diabetes erhöht den Druck auf bestehende Screening‑Strukturen. In Deutschland steigt die Erkrankungsrate von etwa 6,9 Mio. (2015) auf prognostizierte 8,3 Mio. bis 2040 (+21%).
Rund ein Drittel der Betroffenen entwickelt eine diabetische Retinopathie. Viele bleiben lange symptomlos, sodass frühes Screening entscheidend ist.
Nutzen früher Erkennung
Früherkennung und rechtzeitige Behandlung können das Erblindungsrisiko um etwa 56 % senken. Das macht Screening zur präventiven Maßnahme statt einem optionalen Angebot.
Versorgungslücken und Praxisrealität
Der Goldstandard bleibt oft die mydriatische Fundoskopie. Trotzdem fehlen regional Augenarzt‑Kapazitäten und der logistische Aufwand ist hoch.
- Steigende Prävalenz schafft Bedarf an skalierbaren Lösungen.
- Screenings müssen dorthin, wo Patient:innen sind: Hausarzt, Diabetologie, Klinik.
- Digitalisierung, Qualitätsanforderungen und Personalengpässe machen rasches Handeln nötig.
Die Kombination aus fallzahlbedingtem Marktdruck und praktischen Engpässen schafft den Jetzt‑Moment für neue, prozessoptimierte Screening‑konzepte.
Was ist IDx-DR und welche Zulassungen sind für Deutschland wichtig?
Zulassungen bestimmen, wie ein Screening‑System rechtlich und klinisch verwendet werden darf. Sie sind ein Qualitätsindikator, aber nicht eins-zu-eins übertragbar zwischen Märkten.
FDA-Zulassung und CE-Kennzeichnung als Medizinprodukt (Klasse IIa)
Die FDA‑Zulassung belegt eine strenge US‑Prüfung. Die CE‑Kennzeichnung (Klasse IIa) erlaubt den EU‑Marktzugang und bringt Pflichten für Beschaffung und Qualitätsmanagement mit sich.
Indikation und Zielgruppe
Das Produkt ist für Erwachsene mit Diabetes ohne bekannte Retinopathie vorgesehen. Ziel ist das frühzeitige Erkennen von mehr als milder, sogenannter referable/mtmDR.
Autonomes System vs. Entscheidungsunterstützung
Autonom bedeutet: Das System liefert eine eigenständige Klassifikation statt nur einen Hinweis für Ärzt:innen. In der Praxis heißt das:
- Bedienung durch geschultes Personal möglich.
- Überweisungen können anhand des Ergebnisses initiiert werden.
- Die Klinik bleibt für Follow‑up und endgültige Diagnostik verantwortlich.
Wichtig: Screening triagiert und priorisiert Fälle. Es ersetzt nicht die vollständige augenärztliche Untersuchung.
idx-dr ai im Produkt-Check: Funktionsweise, Workflow und Output
Der Produkt-Check konzentriert sich auf Funktionsweise, Workflow und die direkte Nutzbarkeit im Praxisalltag.
Aufnahmeprotokoll
Standard ist jeweils 2 Aufnahmen pro Auge (typisch Papille und Makula). Das System akzeptiert gängige Formate, inklusive DICOM, was Integration in PACS-/RIS‑gestützte Abläufe erleichtert.
Cloud-basierte Analyse
Die Analyse läuft cloud-basiert und liefert ein Ergebnis in unter einer Minute. Es erfolgt keine manuelle Nachbefundung durch Human Grader im Screening‑Pfad.
Klare Ergebnislogik
Ausgabe-Kategorien sind: Exam quality insufficient, negative for referable DR, Moderate DR detected oder Vision-threatening DR detected. Diese Labels lassen sich direkt in Entscheidungspfade übersetzen.
Bildqualitäts-Feedback
Ein sofortiges Qualitäts-Feedback ermöglicht Retakes direkt am Gerät. Das reduziert Nachrufe und erhöht den Durchsatz, wenn lokale Protokolle Retakes erlauben.
Schnittstellen & Integration
Für die Praxis wichtig: Befundtext, Kategorie, Zeitstempel und Bildreferenzen müssen in die Praxissoftware/EHR exportierbar sein.
- Workflow (kurz): Anmeldung → Kamera-Setup (non‑mydriatisch möglich) → 2 Aufnahmen/Auge → Upload → Ergebnis → weitere Aktion.
- IT-Relevanz: DICOM‑Support erleichtert Einbindung in bestehende Archiv- und Dokumentationssysteme.
- Operative Auswirkungen: Zeitgewinn durch
Klinische Evidenz aus der Praxis: Leistungsdaten aus einem deutschen Real-World-Setting
Praxisnahe Daten aus Deutschland liefern konkrete Leistungskennzahlen für den Routineeinsatz.
Studiendesign kurz
Prospektive Querschnittsstudie in Karlsburg mit 875 Patient:innen. Aufnahmen erfolgten non‑mydriatisch durch geschulte Assistenzkräfte.
Als Referenz diente die mydriatische Fundoskopie durch Augenärzt:innen.
Performance bei guter Bildqualität
Bei auswertbaren Bildern zeigte sich eine hohe Trefferquote für schwere, vision‑bedrohliche Retinopathie.
Sensitivität 94,4 % und Spezifität 90,5 % unterstreichen den Wert im Screening‑kontext.
Übereinstimmung und Kappa
Exakte Übereinstimmung lag bei 54,2 % (nur analyzable) und 34,2 % über alle Fälle. Kappa‑Werte reichten von 0,16 bis 0,54, je nach Vergleichsgruppe.
Interpretation: Moderate bis geringe Übereinstimmung hängt stark vom Fallmix, den Kategorien und von nicht auswertbaren Bildern ab.
Over‑ vs. Undergrading
Undergrading war selten (4,8 % analyzable), Overgrading häufiger (41,0 % analyzable). Das bedeutet mehr Überweisungen, aber ein geringeres Risiko, schwere Befunde zu übersehen.
Fazit: Die Daten belegen solide Erkennungsraten für vision‑bedrohliche Fälle. Prozessqualität—Training, Retake‑Strategie und Pupillenmanagement—bleibt entscheidend für reale Performance.
Grenzen & Risiken: Wenn Bildqualität zum Nadelöhr wird
Technische und physiologische Hürden machen Bildaufnahme zum kritischen Engpass im Screening‑Prozess. In der deutschen Studie entstanden rund 10,5 % kein Bild (häufig durch Miosis) und 26,1 % wurden vom System als not analyzable klassifiziert.
Häufigkeit und Geschäftsauswirkung
Rechnet man beides zusammen, fehlen in etwa 36 % der Fälle verwertbare Ergebnisse. Für den Business Case heißt das: mehr Folgeaufwand, zusätzliche Termine und vermehrte Überweisungen.
Non-mydriatisch versus mydriatisch
Non-mydriatisch schützt Patient:innen vor Pupillenerweiterung und vereinfacht den Workflow. Es verschlechtert aber oft die Bildqualität.
Mydriatisch verbessert Bilder, ist aber eine medizinische Maßnahme mit Aufwand und Risiken. Entscheider:innen müssen diesen Zielkonflikt abwägen.
Praktische Bedeutung von „insufficient test quality“
Insufficient test quality ist kein klinischer Ausschluss, sondern eine Prozessentscheidung. Sie verlangt definierte Fallbacks: sofortiger Retake, späterer Termin, alternative Diagnostik oder direkte Überweisung.
- Unterschied „kein Bild“ vs. „unanalyzable“: ersteres ist oft physiologisch, letzteres Qualitätsmängel trotz Bild.
- Häufige „insufficient“-Ausgaben können Vertrauen und Versorgungsqualität belasten.
- Vor Rollout: Zielwerte für Unanalyzable‑Quoten, Retake‑Regeln und Eskalationspfade festlegen.
Wichtigste Einflussfaktoren auf die Auswertbarkeit
Bildqualität ist steuerbar. Sie entsteht durch Technik, Routine und Training. Das bedeutet: Interventionen zahlen sich aus.
Examiner-Effekt und Lernkurve
Unterschiede zwischen Untersucher:innen sind messbar. Ein MD-Student reduzierte „not analyzable“ von 46,9 % (Tag 1) auf 0 % (Tag 4).
Nach 196 Tagen ohne Praxis stieg die Rate wieder auf 18,8 %. Die Aufnahmezeit fiel von 219±59s auf 137±16s.
Fazit: Schulung amortisiert sich durch weniger Retakes und stabileren Durchsatz.
Pupillengröße (Miosis)
„Kein Bild“ trat in 10,5 % der Fälle auf und korrelierte stark mit Miosis. Das macht Pupillenstatus zum zentralen Confounder.
Maßnahmen wie Raumabdunkelung oder kurze Vorbereitungschecks reduzieren diesen Engpass.
Alter, Visus und weitere Faktoren
Höheres Alter und schlechterer Visus verschlechtern die Analyzability. Erwartungsmanagement je Standort ist wichtig.
- Checklisten vor Aufnahme (Position, Fokus, Tränenfilm).
- Klare Abbruchkriterien und Eskalationspfade.
- Definierte Schwellen für Überweisung statt endloser Retakes.
Für wen lohnt sich IDx-DR besonders? Einsatzszenarien in Deutschland
Sinnvoll einsetzbar ist das System primär in Umgebungen mit hohem Screening‑Volumen und limitierter Facharztversorgung.
Diabetologische Zentren, Hausarztpraxen und Screening‑Programme
Diabetologische Schwerpunktpraxen profitieren durch schnellen Durchsatz und Priorisierung von Fällen. Hohe Fallzahlen steigern den wirtschaftlichen Nutzen.
Hausarztpraxen an Orten mit geringer Augenarztanbindung gewinnen durch lokale Triage-Möglichkeiten.
Regionale Screening‑Programme können standardisierte Abläufe etablieren und Wartezeiten reduzieren.
Ressourcenlimitierte Settings: Fokus auf Erkennung vision‑bedrohlicher DR
Der Kernnutzen liegt in der sicheren Identifikation schwerer Fälle.
Bei guter Bildqualität liegt die Sensitivität für vision‑bedrohliche DR bei 94,4 % und die Spezifität bei 90,5 %.
So werden begrenzte Überweisungskapazitäten effizient genutzt.
Patient Journey: vom Screening‑Ergebnis bis zur Überweisung
Der Ablauf ist klar und handhabbar: Aufnahme → automatische Auswertung → Handlungspfad.
Ergebnis „negativ“: Rescreening‑Intervall planen. Ergebnis „referable/vision‑threatening“: Termin- und Überweisungsprozess auslösen.
„Insufficient“: Retake vor Ort oder Alternativpfad definieren.
- Kommunikation: Patient:innen klar unterscheiden zwischen Screening‑Ergebnis und endgültiger Diagnose.
- Prozess‑Design: Vorab kooperierende Augenärzte, standardisierte Befundübermittlung und Priorisierung nach Schweregrad.
- Empfehlung: Retake‑Regeln und Eskalationspfade schriftlich festlegen.
Implementierung im Betrieb: Anforderungen, Prozesse und Qualitätssicherung
Betriebsreife entsteht durch klar definierte Prozesse, Verantwortlichkeiten und kontinuierliches Monitoring. Vor dem Rollout empfiehlt sich eine kurze Pilotphase, um Abläufe und KPIs zu prüfen.
Rollen & Verantwortlichkeiten
Definieren Sie, wer die Aufnahme durchführt, wer Plausibilitätsprüfungen vornimmt und wer die Patientenkommunikation übernimmt.
Wichtig: Auch ohne Augenarzt vor Ort muss klar sein, wer Überweisungen oder Telekonsile initiiert.
Prozessdesign und Retake‑Strategie
Legen Sie SOPs fest: Wie oft wird bei insufficient test quality ein Retake versucht, wann wird abgebrochen und welche Alternativen gelten (Überweisung, mydriatische Untersuchung, Tele‑Ophthalmologie).
Dokumentation und Terminlogik
Speichern Sie Bilder, Ergebnis‑Kategorie, Zeitpunkt und Bediener:in. Implementieren Sie automatisierte Recall‑Regeln: regulärer Rescreen bei „negativ“, schnelle Eskalation bei „referable/vision‑threatening“ und separater Pfad für „insufficient“.
Qualitätsmanagement & Datenschutz
Monitoren Sie regelmäßig die Quoten für „unanalyzable“ und „kein Bild“ pro Standort und Examiner. Nutzen Sie Trendanalysen, um Schulungen abzuleiten.
Für Cloud‑Nutzung prüfen Sie AV‑Vertrag, Datenflüsse, Zugriffskonzepte, TOMs und Löschfristen in Abstimmung mit Datenschutzbeauftragten und IT‑Security.
- Pilotphase mit KPIs: Durchsatz, Auswertbarkeitsquote, Überweisungs‑ und Rückrufquote.
- Ziel: Stabil niedrige unanalyzable-Quoten durch Training und SOP.
- Regelmäßige Reviews und Nachschulungen als fester Bestandteil des QM.
Preis-Leistungs-Einschätzung: Nutzenargumente für Entscheider mit Commercial Intent
Ökonomische Bewertung fokussiert auf Time-to-Result, Prozessstandardisierung und Folgekosten bei nicht auswertbaren Bildern. Ein Ergebnis in < 1 Minute und kein Human Grader erforderlich sind starke Value‑Treiber für hohe Fallzahlen.
Werttreiber
Schnelle Ergebnisse: Rasche Befunde reduzieren Wartezeiten und erlauben direkte Handlungspfade.
Weniger Overhead: Standardisierte Abläufe sparen Koordination und senken administrative Kosten.
Skalierbarkeit: Screening lässt sich an mehr Standorten und Zeitslots ausrollen, da keine fortlaufende Befundung durch externe Grader nötig ist.
Kostenrisiken
Real‑World-Daten zeigen Risiken: 10,5% kein Bild und 26,1% unanalyzable. Diese Quoten verursachen Retakes, Folgetermine und Zusatzkosten.
Overgrading (41,0% analyzable) kann Überweisungen erhöhen; Undergrading (4,8%) bleibt vergleichsweise selten.
Vergleichslogik
- Autonomes System: Schnell und standardisiert, abhängig von Bildqualität und IT‑Infrastruktur.
- Tele‑Ophthalmologie: Flexibler, aber laufende Befundkosten und längere Turnaround‑Zeiten.
- Mydriatische Funduskopie: Höchster klinischer Standard, jedoch ressourcenintensiv und weniger skalierbar.
Entscheidungsrahmen: Wählen Sie nach Volumen, Patientendemografie (Miosis/Alter), vorhandener Kamera‑Infrastruktur und Fähigkeit, erhöhte Überweisungsraten zu managen.
Fazit
Kurz gesagt: Technologie liefert Ergebnisse – der Praxisbetrieb macht sie verlässlich.
idx-dr ist FDA‑autorisiert und CE‑markiert und zeigte in einer deutschen Real‑World‑Studie hohe Trefferquoten für schwere Retinopathie (Sensitivität 94,4 %, Spezifität 90,5 %).
Alltagshürden sind real: 10,5 % kein Bild und 26,1 % unanalyzable. Haupttreiber sind Examiner/Training, Miosis, Alter und Visus.
Empfehlung für Entscheider:innen: Pilotieren mit klaren KPIs (Auswertbarkeit, Durchsatz, Überweisungs‑ und Rückrufquote). Feste SOPs, Retake‑Strategien und kontinuierliches Monitoring sind nicht verhandelbar.
Bei hohem Screening‑Volumen und limitierter Augenarztversorgung erweitert das System die Kapazität. Ergänzen Sie den Einsatz durch Tele‑Ophthalmologie oder lokale Fallback‑Diagnostik für nicht auswertbare Fälle.